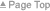研究・学会活動
研究のテーマ
Continence Research Group(コンチネンス・リサーチグループ)
ゲノム薬理学に基づく前立腺肥大症の病態解明とオーダーメード医療
―高齢者QOL向上にむけた新しい至適個別化治療法の開発―
前立腺肥大症は、排尿困難、残尿感、頻尿、尿意切迫感などの下部尿路症状を引き起こす疾患で、60歳以上の中高年男性の約60%以上に発症します。排尿障害は、患者のQOLを著しく低下させるために、超高齢化社会を迎えたわが国においては、大きな社会問題となっているといっても過言ではありません。
α1遮断薬は、前立腺による閉塞を緩和させることによりその効果を発揮し、今日では前立腺肥大症に対する第一選択薬として位置付けられています。しかし、α1遮断薬は効果的で標準的な薬物治療とは言いながら、その一方で個々の症例をみると、短期もしくは長期経過観察の中で、経験的に効果的な患者さんと効果的でない患者さんが存在し、またいったん効果を認めても長期経過の中で尿閉を発症したり、最終的に手術を必要とする患者さんに遭遇します。つまり薬剤効果には個人差があります。その原因のひとつとして、薬剤の応答性が遺伝的背景に基づいて個々の患者さんによって異なる可能性が考えられます。
ゲノム薬理学とは、患者さんの個々遺伝子情報をもとにして、短期および長期にわたる薬剤効果や副作用を予測し、治療に応用するという研究分野です。一般的に、さまざまな疾患に対して薬物治療を行う上で、ひとつの薬剤が同じ疾患を有する患者さんすべてに効果的であるというわけではありません。つまり薬剤の効果は、その患者自身が個別に有する遺伝的背景に基づいて決まると考えられます。この概念を礎として期待されている治療は、これまで行われてきた個人差を無視した集団に対する統計学的情報をもとにした薬物治療ではなくて、今後は患者さん一人一人を薬剤に対するレスポンダーとノンレスポンダーとに識別し、至適個別化することによる効率的な薬物選択と投与計画実現させるという、いわゆる“オーダーメード医療”です。
私たちは、前立腺肥大症や過活動膀胱のような下部尿路機能障害を有する患者さんの個々の遺伝的特徴を明らかにすることにより、より効率的で安全な薬物治療が可能であるのではないかと考えています。機能ゲノム科学の進歩により、様々な疾病の原因解明や診断による効率的な治療の選択が可能になることが予測されます。将来的に、前立腺肥大症や過活動膀胱のようなQOL疾患に対しても、患者の遺伝的体質に合わせた処方や治療計画が期待されます。私たちは、これら疾患に対する薬物治療における適正用量および薬剤効果を服薬前に予測する、より詳細なアルゴリズムを作成し、高齢者のQOLの向上に役立てたいと考えています。
male LUTS
福島医大泌尿器科の下部尿路機能に関する研究は、常に新しい治療法に結び付く可能性を求めて続けられており世界トップクラスです。その中で最も大きな業績は種差の大きい膀胱のβ受容体に関して人の膀胱平滑筋ではβ3受容体の発現が97%を占め、弛緩反応に関与していることを明らかにしてきた事です(J Urol 680-685 1999, J Urol 649-653 2003)。これは世界初の過活動膀胱治療薬β3刺激薬が日本から生まれた原動力となりました。同様に加齢に伴い前立腺のNO含有神経が減少し前立腺の弛緩反応が減弱すること(Prostate 40-46 2001)やRhoA/Rho-kinaseが膀胱の持続的緊張を高めること(Neurourol Urodyn 257-262 2009)を明らかにしPDE5阻害薬やRho-kinase阻害薬の下部尿路症状治療への可能性を示しました。アメリカでは現在PDE5阻害薬(シアリス)が前立腺肥大症の治療薬として使われ始めています。現在も神経保護作用や平滑筋の増殖・収縮に関与する新しい標的物質を検討しています。最近は下部尿路症状発生に重要な因子であると考えられるメタボリックシンドロームと下部尿路機能障害の関わりや、その治療戦略の研究に欠かせない動脈硬化ラットモデルを開発してきました(Neurourol Urodyn 195-200 2012)。今後このモデルを使った研究は大きなインパクトを持った成果を上げられると確信します。
下部尿路症状を訴える患者さんは非常に多くその治療は泌尿器科医だけでなく他科の医師もかかわっています。もう一つ我々の重要な役割は専門家として非専門医に有用な情報を提供し、安全で有効な治療ができるようにすることです。我々は抗コリン薬やα1遮断薬の蓄尿症状改善作用の機序に関してパラダイムシフトとなる下部尿路からの求心性刺激の抑制が主たるメカニズムであることを明らかにしました(Urology 200-204 2009, Neurourol Urodyn 461-467 2011)。正しい作用機序の解明は適切な治療選択に欠かせないと思われます。今後は下部尿路症状に対して使用可能になった多くの治療薬の最適な使い分けに向けて、患者の症状による新しい分類(BJU Int 408-412 2012)や遺伝子学的な情報も加味した患者選択など最先端の研究テーマが広がっており一緒に研究するたくさんの仲間を必要としています。

ラット脊髄L6のc-Fos陽性細胞(矢印)は、コントロール(A)に比べ
オキシブチニン投与(B)で有意に減少し求心性刺激が減弱したことを示す。
Female Urology
これまで膀胱瘤・子宮脱・直腸瘤といった骨盤臓器脱患者の骨盤MRI撮影を行い、画像解析から正常との違いや病態、危険因子の解析を試みてきました。同様の研究は海外でも行われていますが、国内ではほとんど報告がありませんので、日本人女性についての研究が不可欠と考えています。最近では、肛門挙筋や骨盤形態を計測し、膀胱瘤発生やそのグレードとの関連を解析しています。今後は更なるデータの蓄積はもちろんのこと、骨盤臓器脱のみならず尿失禁との関連についてもMRIやエコーを使用して解析していきたいと考えています。
過活動膀胱(overactive bladder:OAB)
OABとは、尿意切迫感、頻尿そして切迫性尿失禁を主症状する症候群であり、加齢とともにその有病率は増加し、QOLを著しく低下させます。本邦では40歳以上の成人における本疾患の実数は約810万人にもなることが推定されており、超高齢化社会を迎えて、OABの病態解明と治療法の開発は急務です。これまで、我々の教室は、OABの発症メカニズムの解明とその治療法の開発に多くの力を注いでまいりました。独創的かつユニークな研究の一端を紹介いたします。
1.「ヒト膀胱平滑筋に発現するα1とβアドレナリン受容体サブタイプの発現量とそれぞれのサブタイプの膀胱機能に果たす役割についての検討」
当時、膀胱平滑筋に発現するα1Dアドレナリン受容体サブタイプが、OABの発症に重要な役割を担うのではないという論議が盛んになされた時代。蓄尿期におけるα1アドレナリン受容体とβアドレナリン受容体のバランスこそが重要であること説いた研究であり、10年後に新たなOAB治療薬として登場することとなるβ3アドレナリン受容体作動薬開発の基礎となる研究です。この研究は、国内国外の学会で報告され、多くの論文に引用されるエポックメイキングな研究でもあります。
2.「OABとβ3アドレナリン受容体遺伝子変異の関連性」
頭髪の毛根一本からβ3アドレナリン受容体の遺伝子変異を調べ、OABの診断と予測に役だたせようとする研究であり、国際学会で学会賞にも輝いております。
3.「Patient Trust Study」
21名のintelligent female OAB patientsを対象にし、排尿毎の尿意のグレード(尿意の感覚をスケール化)と膀胱容量の関係を調査することによって、OAB患者の排尿行動と尿意の感覚に関する新たな知見を加えた有名な研究です。
4.動物モデルを用いて、抗コリン薬やα1アドレナリン受容体遮断薬の蓄尿症状(OABに関わる症状)改善作用の機序に関してパラダイムシフトとなる下部尿路からの求心性刺激の抑制が主たるメカニズムであることを明らかにしました。これらの研究は、国内国外の学会で発表され、有能な若手泌尿器科医の登竜門「河邊賞」を受賞した研究でもあります。
5.「動脈硬化性変化に伴う慢性膀胱虚血ラットモデルの開発」
メタボリック症候群や生活習慣病と膀胱機能障害やOABとの関連性に着目し、世界に先駆けて慢性膀胱虚血ラットモデルを確立した研究であり、国際学会で学会賞を受賞しました。福島医大泌尿器科で開発されたこの動物モデルは、日本国内のみならず、韓国やアメリカにも導入され、加齢に伴う血管性要因(動脈硬化)と膀胱機能の関連性を研究する上で有用なツールとなると思われます。
私たちは、臨床に直結し、臨床医が診療に役立つ情報、そして排尿で困っている患者さんに還元できる研究を目指しております。この疾患の発症メカニズムの解明と治療法の開発に、一緒に取り組み、夢を共有できる仲間が必要です。